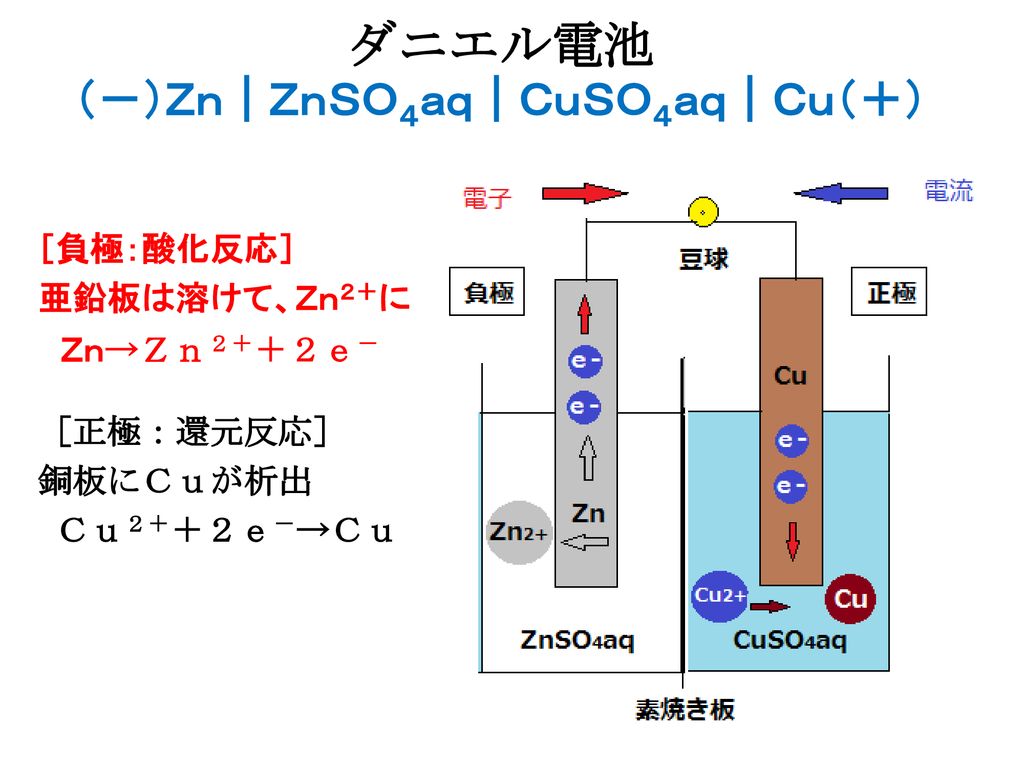
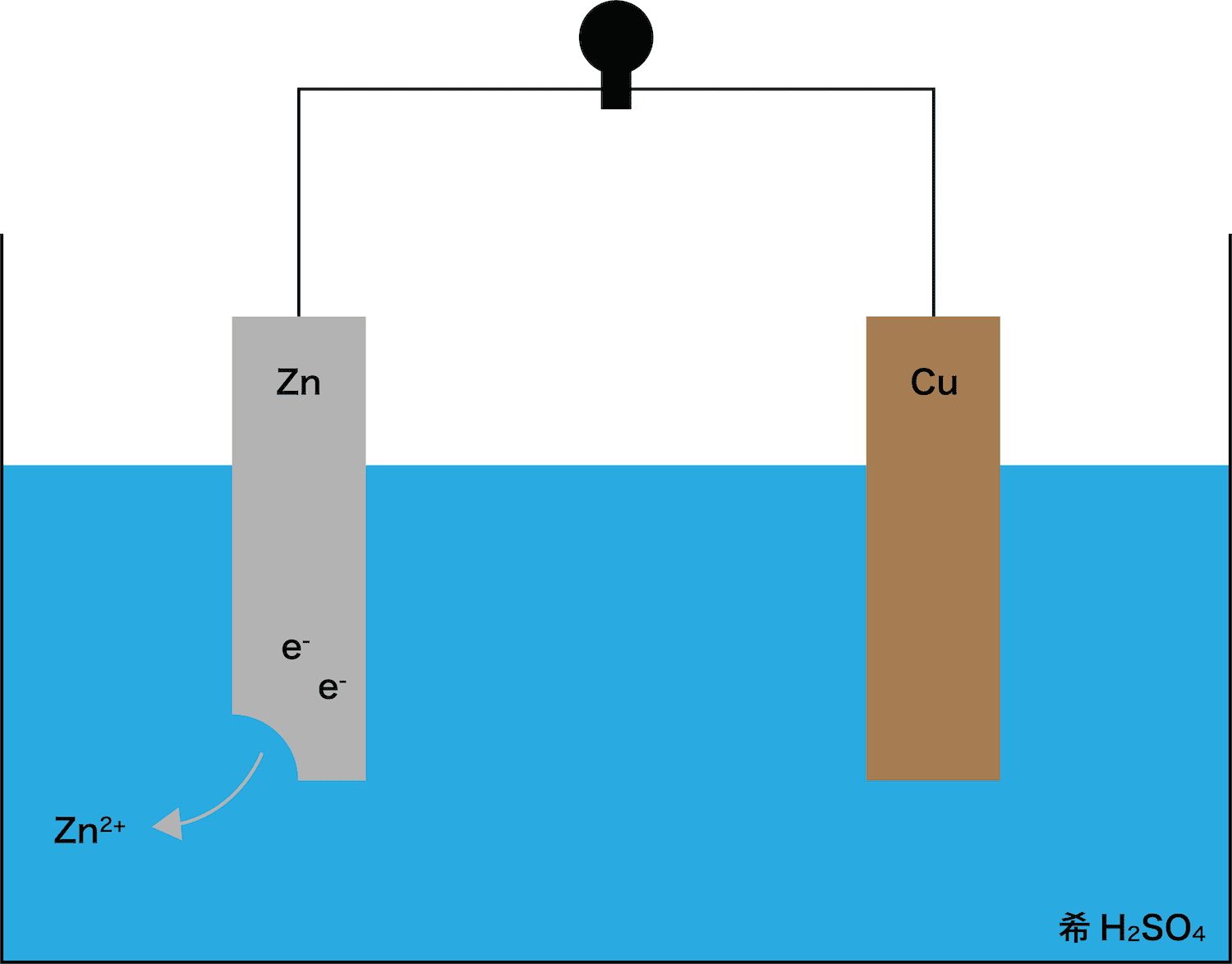
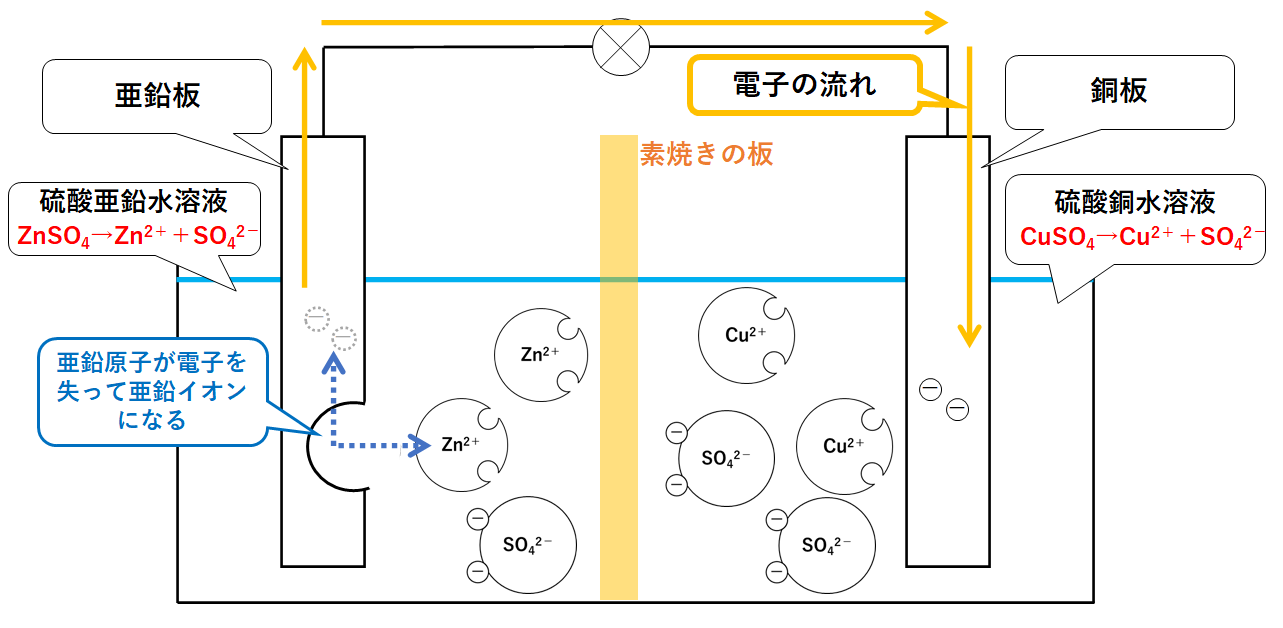
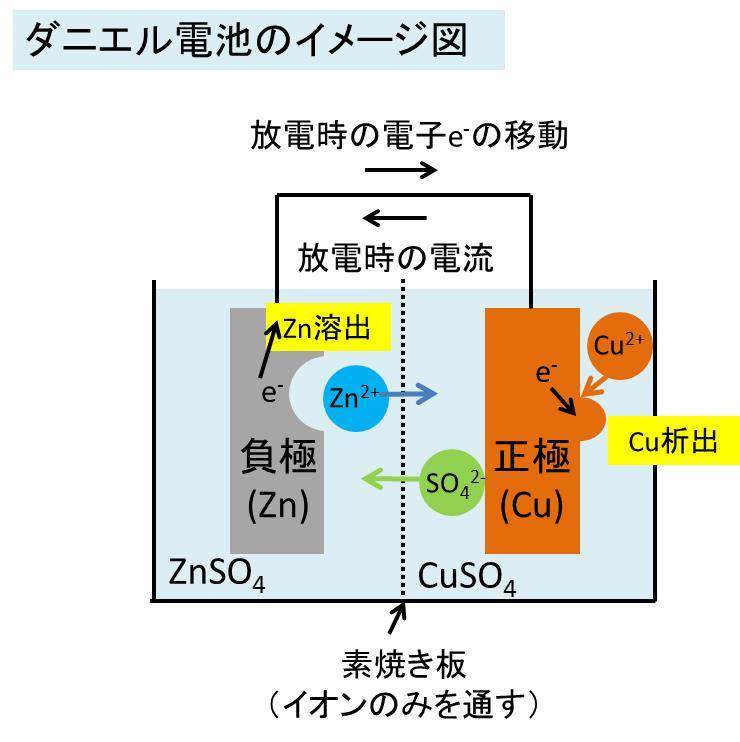
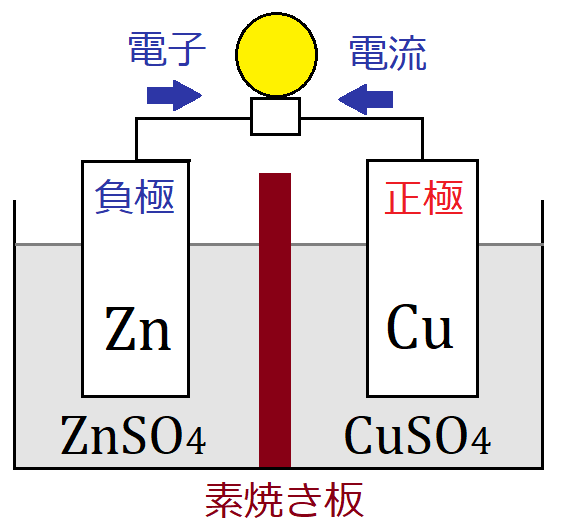
イオン化傾向と電池 イオン化傾向とは、金属単体が水溶液中で電子を失いやすさ 遷移元素の金属 イオン化傾向の高い順に反応しやすい 水と金属の反応 空気と金属の反応 電池の原理は酸化還元反応 還元剤の方が負極 酸化剤の方が正極Zn SO Cu 4 2Zn2 Cu2 Zn2 Cu2 SO 4 2SO 4 2素焼きの円筒(Hしか通さない) e e ダニエル電池 電池電圧: 11 V どのように決まる?ア ダニエル電池の起電力である11 vを超える電圧を加えること。 イ 陰極での銅(Ⅱ)の析出をさせないこと。 ウ 気体発生反応を起こさせないこと。 エ 電池の負極となる亜鉛電極上で、亜鉛イオンが還元され析出すること。

ボルタ電池の反応式は 欠点の分極とその解決策まとめ 化学受験テクニック塾
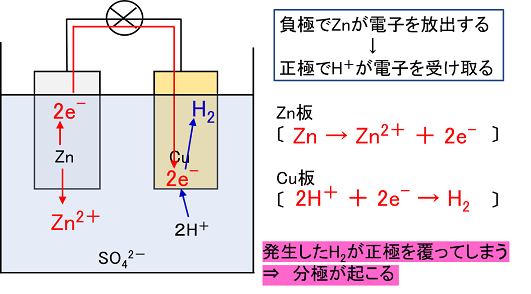
ダニエル電池 気体発生
ダニエル電池 気体発生-質問 「イオン式」ではなく,「化学式」が使われているのはなぜですか? 回答 中学校学習指導要領(平成29年告示)解説 理科編において,「イオン式」という言葉が用いられなくなり「化学式」で表記されるようになったことと,日本化学会の提言を踏まえ,令和3年度の教科書よりダニエル電池 3年生は、理科で「ダニエル電池」について学習しています。 「ダニエル電池」は、「ボルタ電池」とは異なり、気体が発生しない(分極作用が起こらない)電池として学習します。 今年度からの新しい教材ということで、JAEA敦賀総合研究



ボルタ電池とダニエル電池の違い 改良点を理解しよう
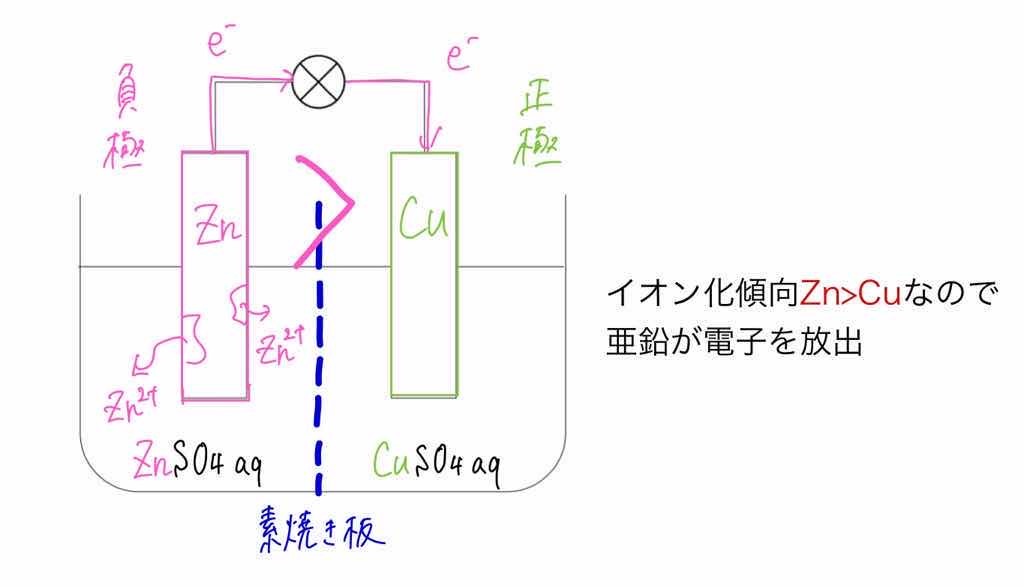
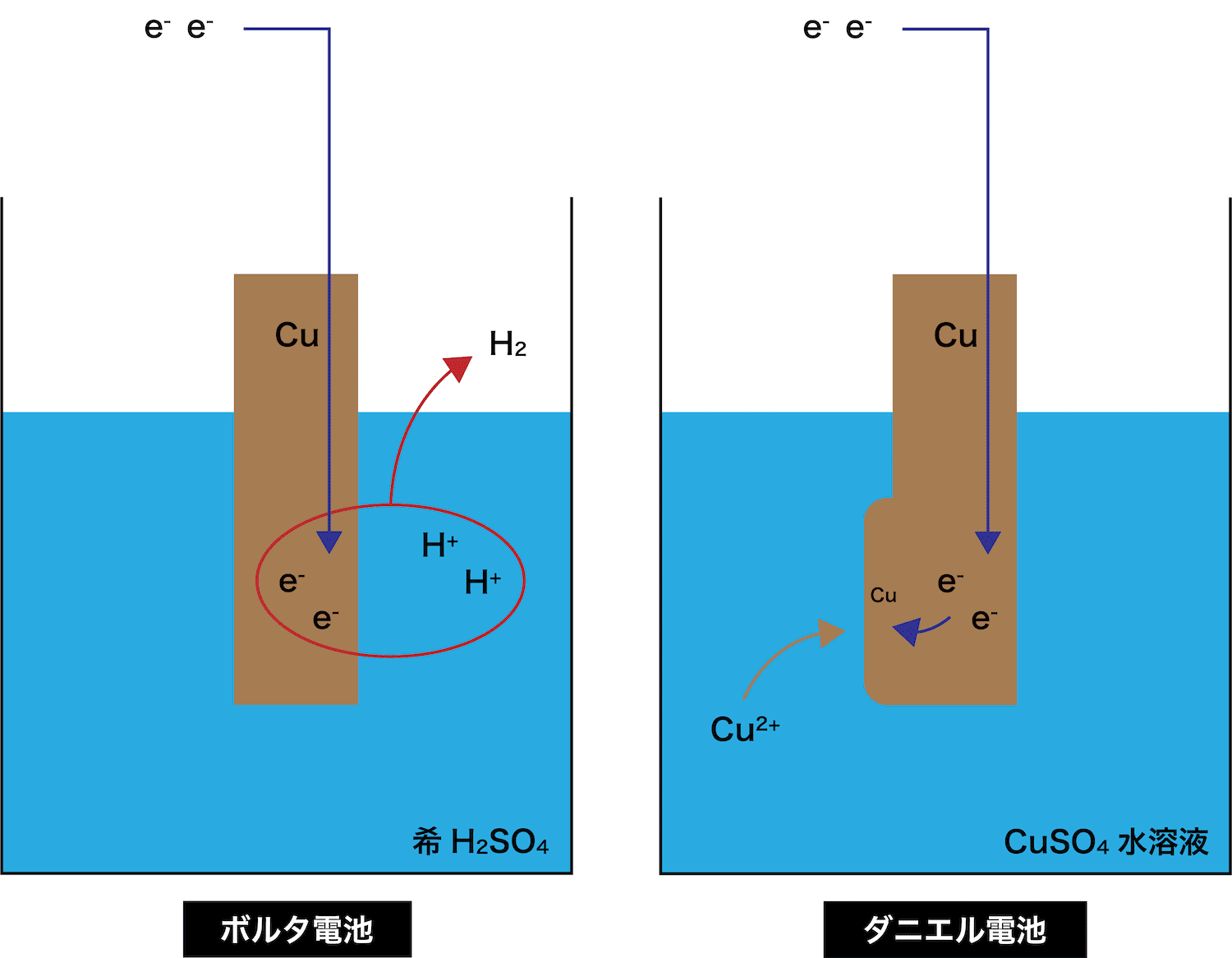
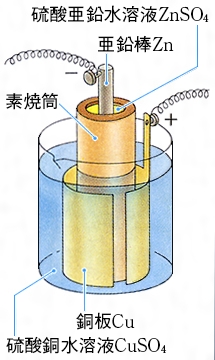
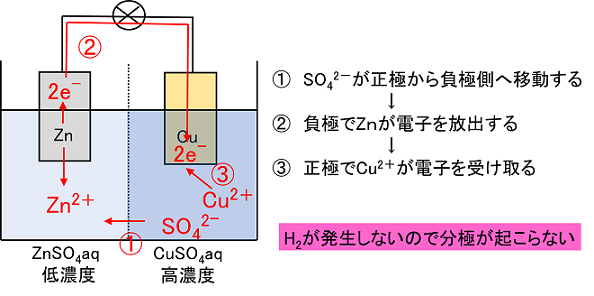
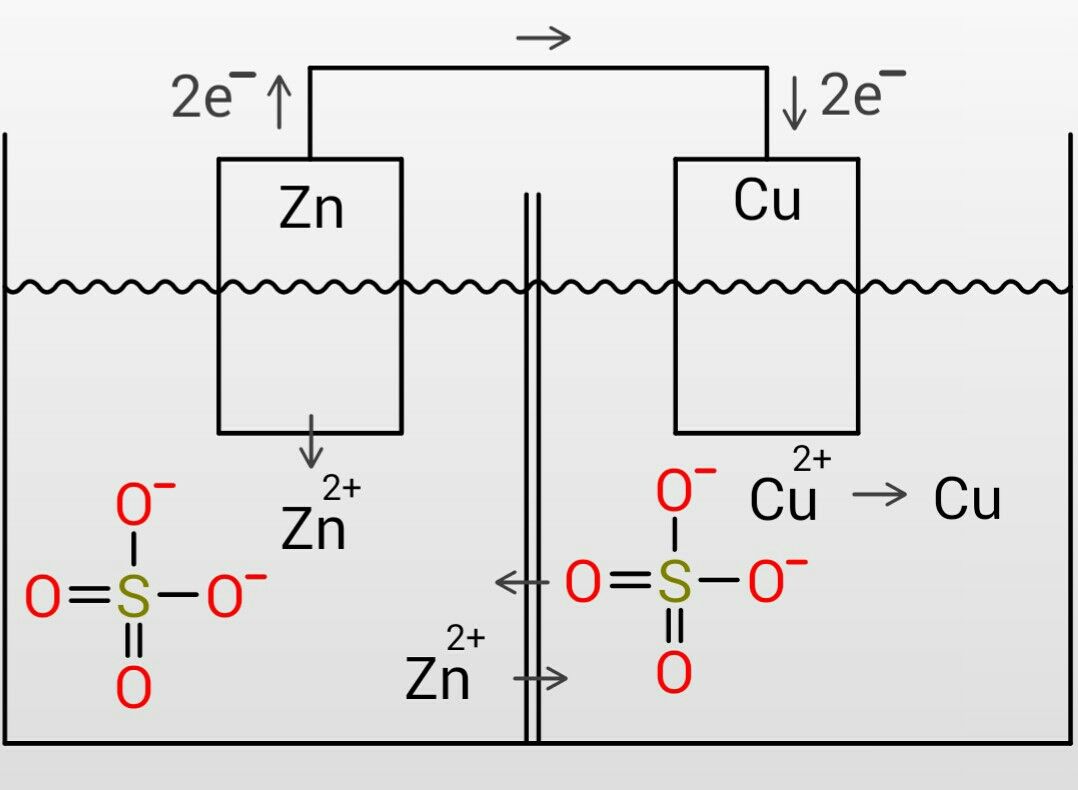
化学分野 の「2)身の回( りの 物質 」の単元 では 、中和 や気体 の発生 などの 化学変化 の基礎的 な部分 を学んで いる 。 中学校 2年生 ではそれらを 発展 させて 「4)( 化学変化 と原子 ・分子 」において 原子 ・分子 についての 電極の銅が\ {Cu e Cu}\ のように電子を受け取ることはできない {H}が還元されることで発生するH₂が原因で分極が生じるため,\ 実用性はない H₂によって分極するというボルタ電池の欠点を克服したのがダニエル電池である 正極側の電解液にCuSO₄aq}をボルタ電池の水素発生,起電力の不安定を解消し,実用可能な電池として開発された。 硫酸銅( CuSO 4 )水溶液に銅板を,硫酸亜鉛( ZnSO 4 )水溶液に亜鉛板を浸漬し,溶液間でイオンの移動が可能な半透膜(陶器の板)を介して接触させ,銅板と亜鉛板を導線で結ぶと,水素発生を伴わないで
・ ダニエル電池:jfダニエルが16年に発明し た化学一次電池。素焼きの容器や半透膜で電解液を 分離し、プラス側に硫酸銅水溶液、マイナス側に硫 酸亜鉛水溶液を用いることによって起電力の変化が 少なく、気体も発生しない実用性が向上した電池と⑴ 電池(化学電池)物質のもつ化学エネルギーを電気エネル ギーに変える装置。 ⑵ ボルタ電池電解質の水溶液と亜鉛板,銅板の1組からでき ているもの。短時間しか使えず,安定した電源にならず,扱い にくい。 ⑶ ダニエル電池藤枝理科サークル「SCIENTIA」のニュース「Serendipity」から転載 (ブログ゙編集人による部分的な編集もあります) SCIENTIAの連絡先 高橋政宏さん (mtakahashi@ra3sonetnejp)内容 (1)Fe+S→FeSの実験について (2)銅は化合したと言えるか(酸化銅への化学変化) (3)酸化銅のマグネシウム
化学 ニューグローバル(東京書籍)という問題集にダニエル型電池において負極にAlとAl2(SO4)3aq、正極にNiとNiSO4aqを用いたとき、正極における反応はNi2 + 2e→Niと書いダニエル電池の起電力Eは硫酸銅と硫酸亜鉛溶液の濃度および温度に依存する。 両溶液の濃度がl mol dm 3 の時,110Vである。 この電位差は銅の側に0337V,亜鉛の側に0763V帰属される。放電すると,正極で気体が発生する。 放電すると,すぐに起電力が落ちる。 放電すると,負極の質量は減るが,正極の質量は変化しない。 問2 図2のダニエル電池に関する記述として誤りを含むものを,次の ~ から 一つ選びなさい。16



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Volta Cell




理科とか苦手で 化学変化と電池09 化学変化と電池 5 ダニエル電池の仕組み
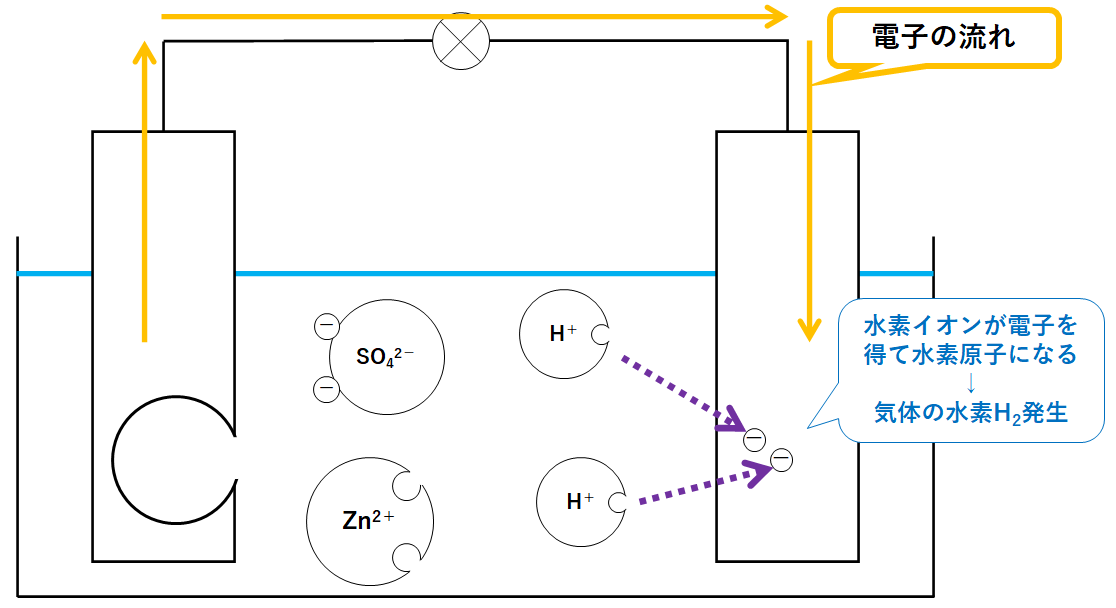
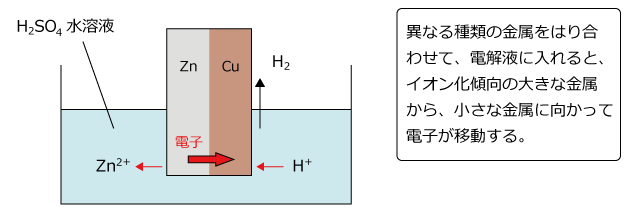
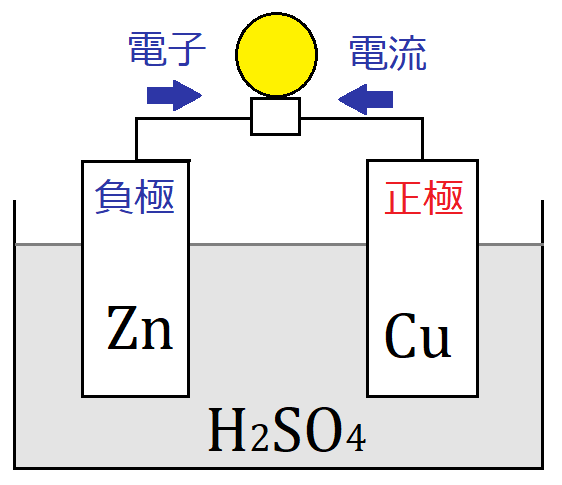
⑶ ダニエル電池で+極になるのは,亜鉛板,銅板のどちらか。 ⑷ 短時間しか使えず,安定した電源にならないのは,ボルタ電池,ダニエル電池 のどちらか。 ⑴ ⑵ ⑶ ⑷ 1 1 1 うすい 塩酸 亜鉛 気体が 発生 変化なし 硝酸銀水溶液 うすい 塩酸 銅 銅 銀が ボルタの電池のしくみは次の通りです。 ①負極の亜鉛版が溶け出してZn2になり、電子を放出する ②負極から正極に向かって電子が移動する ③電解質水溶液中にある陽イオンである水素イオンHが電子eを受け取って、気体の水素H2が発生するコードNo 定価 13,0円 会員価格 12,540円 気体発生装置RK-2 コードNo 定価 5,060円 会員価格 4,807円 塩化銅水溶液10% 1L コードNo




ダニエル電池について 長く持続させるために濃度をどうすればいいかがわかりません 教え Clear



ボルタ電池 zn h2so4aq cu Ppt Download
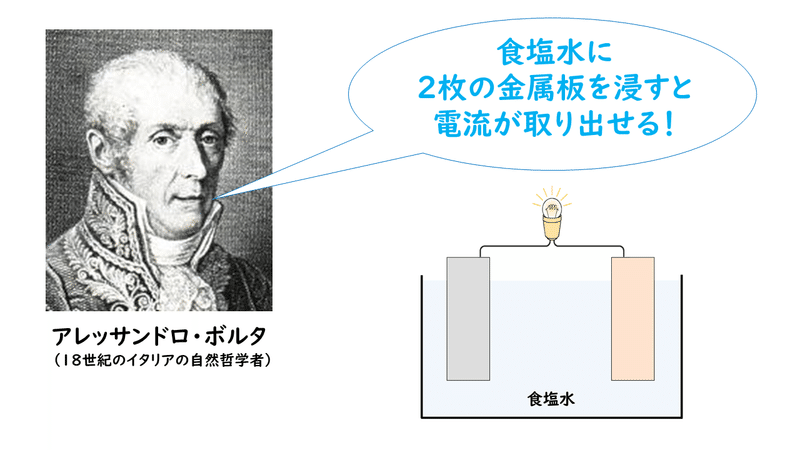
化学電池とは? 教科書や参考書には、 化学電池 について、こう書かれています。 「化学電池」とは、 化学エネルギーを 電気エネルギーに変えるしくみ 具体的には―― 電解質の水溶液に、 2種類の金属板を入れて、 導線でつなぐと電流が発生します。図 2 ダニエル電池の模式図(a),局 部電池ができ る金属/溶液の組合わせ(b),お よび局部電 池ができない組合わせ(c) 図 3 非酸化性の酸性溶液(a)お よび中性溶液(b) 中における鉄の腐食の模式図と局部電池の構 成 Vol 44, No 10, 01 (7 ) 861③ ダニエル電池 したがって、電極Bで発生した気体の2倍の気体が電極Aで発生する。 ② b.③・④の反応より、2モルの電子が流れると、1モルの銅と2モルの銀が生成する。 冬休みの課題(化学基礎・実験器具) NO6



Www Nagano C Ed Jp Seiho Intro Risuka Kadaikenq Paper 06 06 06 Pdf




ボルタ電池の構造と電気が流れる仕組み Chemihack おうちで学べる化学
FdData 高校入試:中学理科3 年:イオン・電気分解・電池 原子とイオン/電離/塩化銅の電気分解/塩酸の電気分解/電池となるための条件/ ボルタ電池 /ダニエル電池/化学→電気エネルギーなど/燃料電池など/ FdData 入試製品版のご案内ダニエル電池の反応 起電力はボルタ電池と同じで11Vですが、正極側での水素の発生がないので 分極は起こらず 起電力はあまり低下しません。 素焼き容器を使う理由は塩橋と同じですが電気が回るため、電流が流れるようにするため、と思っていて下さいダニエルダニエル電池を用いたどんなしくみで電流が流気体が発生しないこと 4電池演示実験れるのか。なぜ、分極しで、分極しないことの ないのか。確認。 実用電池いろいろな実用電池の実用電池の変遷により、環境への配慮について



酸化還元反応の利用 電池と電気分解



高校化学 ダニエル電池の原理を徹底解説 ボルタ電池との違いや素焼き板の意味は 化学の偏差値が10アップするブログ
ボルタ電池はイタリアの物理学者のVoltaが発明した電池で,世界初の化学電池とされています. なお,Voltaは電気の研究に貢献し,電圧の単位であるボルト(V)の由来にもなっています. さて, ボルタ電池は亜鉛Znと銅Cuを導線で繋ぎ,希硫酸$\ce{H2SO4}aq$に浸けるだけのシンプルな構造 で簡単にを組み合わせた電池をダニエル電池という。 2 種類の水溶液は,セロハン膜 まく や素焼き板 で分けられており,すぐに混ざらないよう になっている。 ⑵ ダニエル電池の電極 陽イオンになりや すい亜鉛板が極,陽イオンになりにくい銅板が極となる。製作した電池が、正常に作動するか知るため、その性能 を調べた。 上記の電池によって生じた電池の電圧を測定した後プロ ペラ(モーター)を回転させその時間を計測した。 ・実験のベースとなった電池の詳細 気体の量 h2:o2= 2:1



1




中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理
ダニエル電池の実験 の小規模化はまだ研究途中のため、これからも実験や改良を積み重ねていって研究を進めたいと考えて いる。 私たちの研究の"マイクロスケール化"は今回の〔塩素発生実験〕、〔ハロゲンの反応性の実験〕、〔電①:ダニエル電池における標準起電力を求める。 標準起電力=e r 標準 -e l 標準 =0337-(-0763)=11v ②:移動する電子の数を求める。 ダニエル電池では、亜鉛電極より2個の電子が発生し、銅電極へ移動することから、移動する電子の数(n)は2である。ダニエル電池 標準状態での気体 完全燃焼と発熱 完全燃焼-水の生成量- 溶液のpH-濃度の計算- 溶液のpH-熱量の計算- 燃料電池-電極の質量と気体の発生量の関係-



Www Jst Go Jp Cpse Jissen Pdf Houkoku Sg A Pdf



中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理
発生した析出物によって微小ながら寒天が動かされてしまったのではないかと考えた。 4 ダニエル電池の気体発生抑制実験 1 電池を二次電池化するには、身の回りにある充電池のように気体の発生を抑える。もしくは、発生した気半電池反応における250℃,標 準電極電位 は, Zns→Zn2aq2e0763ボ ルト ΔG0352kcal Cus→Cu2aq2e 0337ボ ルト ΔG0155kcal ダニエル電池の電位差=11 ボルト,2Fの 電荷の移動は1モ ルの亜鉛と,1 モルの銅イオソの反応に相当します。110ボダニエル電池 16 年,イギリス人の化学者ダニエルによって考案されたもので,起電力の変化が少なく,気体も発生しないので,ボルタ電池よりも数段優れたものとして評価された。 当初は銅イオンが亜鉛室に移って自己放電を起こすという欠点があったが,いろいろな構造の改良を行い




ダニエル電池で発電しよう お茶の水女子大学 理科教材データベース




ダニエル電池って その仕組みを理系学生ライターが5分で解説 ページ 2 3 Study Z ドラゴン桜と学ぶwebマガジン




ボルタ電池の反応式は 欠点の分極とその解決策まとめ 化学受験テクニック塾



ボルタ電池 仕組み 各極の反応 分極の理由など 化学のグルメ



ダニエル電池 仕組み 各極の反応式 素焼き版 起電力など 化学のグルメ



Www Mext Go Jp Component A Menu Education Detail Icsfiles Afieldfile 0427 Mxt Kouhou02 181 Pdf



ダニエル電池とは コトバンク



ボルタ電池とダニエル電池の違い 改良点を理解しよう



高校化学基礎 化学電池の仕組み Mm参考書




ボルタ電池とは 仕組み 分極の原理など 理系ラボ



Q Tbn And9gcsdzziblrwie81gbpvi 9iwu97oxtdiwnruxmcmqtirktagxm Usqp Cau



電気化学 電池



1




ダニエル電池 中学 Nhk For School



理科 教科書改訂で理科はどれくらい難しくなるの ダニエル電池 個別指導塾のyou 学舎日記 公式ブログ



理科 教科書改訂で理科はどれくらい難しくなるの ダニエル電池 個別指導塾のyou 学舎日記 公式ブログ



ボルタ電池 Okedic




ダニエル電池の構造と電気が流れる仕組み Chemihack おうちで学べる化学
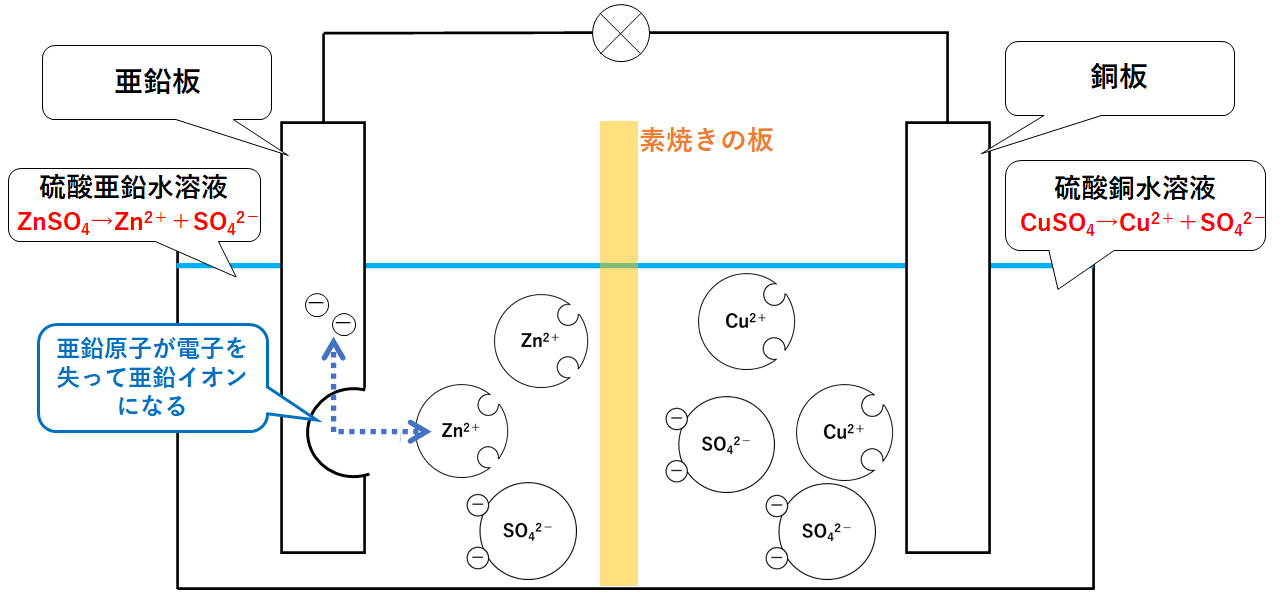



中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理




5 で 水溶液の濃度を変えることで 多くの電気量が得られる仕組みが分かりません Clear
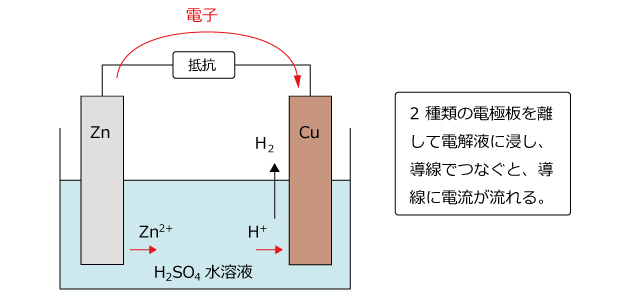



化学講座 第25回 電池 ボルタの電池とダニエル電池 私立 国公立大学医学部に入ろう ドットコム




高2 化学 ボルタ電池 ダニエル電池 電気量計算 高校生 化学のノート Clear
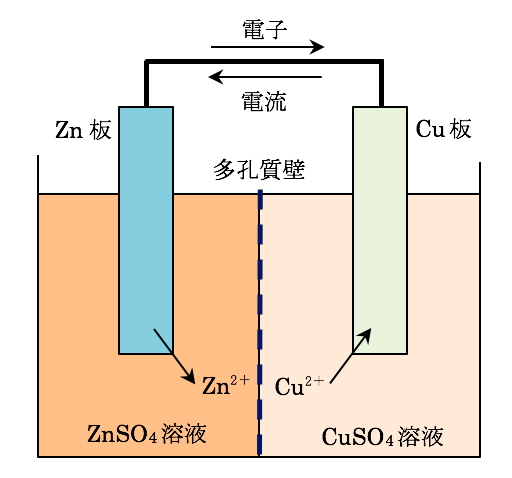



電気化学 Yakugaku Lab




高校化学 ダニエル電池 映像授業のtry It トライイット



化学についてなのですが ダニエル電池の素焼き板がない時と素焼き板を普通の Yahoo 知恵袋
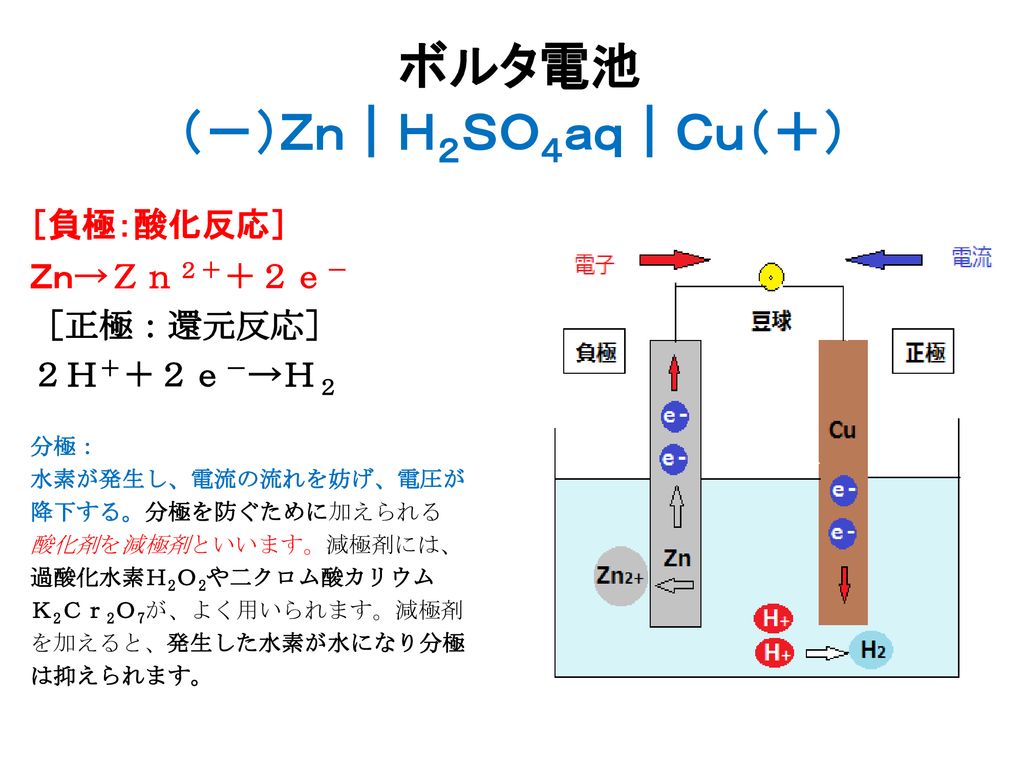



ボルタ電池 zn h2so4aq cu Ppt Download




化学基礎 ダニエル電池 その2原理 Youtube



7 6 電池 1 おのれー Note




ボルタ電池とは 仕組み 分極の原理など 理系ラボ



酸化還元反応の利用 電池と電気分解



化学講座 第25回 電池 ボルタの電池とダニエル電池 私立 国公立大学医学部に入ろう ドットコム




5 で 水溶液の濃度を変えることで 多くの電気量が得られる仕組みが分かりません Clear



理科 教科書改訂で理科はどれくらい難しくなるの ダニエル電池 個別指導塾のyou 学舎日記 公式ブログ




ボルタ電池のしくみ 中学生 理科のノート Clear




解説授業 中3理科をひとつひとつわかりやすく 21 電池のしくみ Youtube



平成12年度 岩手県立総合教育センター 教育研究 理科教育 高等学校化学 酸化還元反応 の電気分野の 学習において現象や法則の理解を深める教材の開発に関する研究



Www Kyoiku Shuppan Co Jp Tsushin Files 12st 04rika Pdf




ダニエル電池まとめ 起電力 素焼き板と濃度 原理 理系ラボ



ボルタ電池 仕組み 欠点 分極 起電力 西住工房



ダニエル電池 Wikipedia
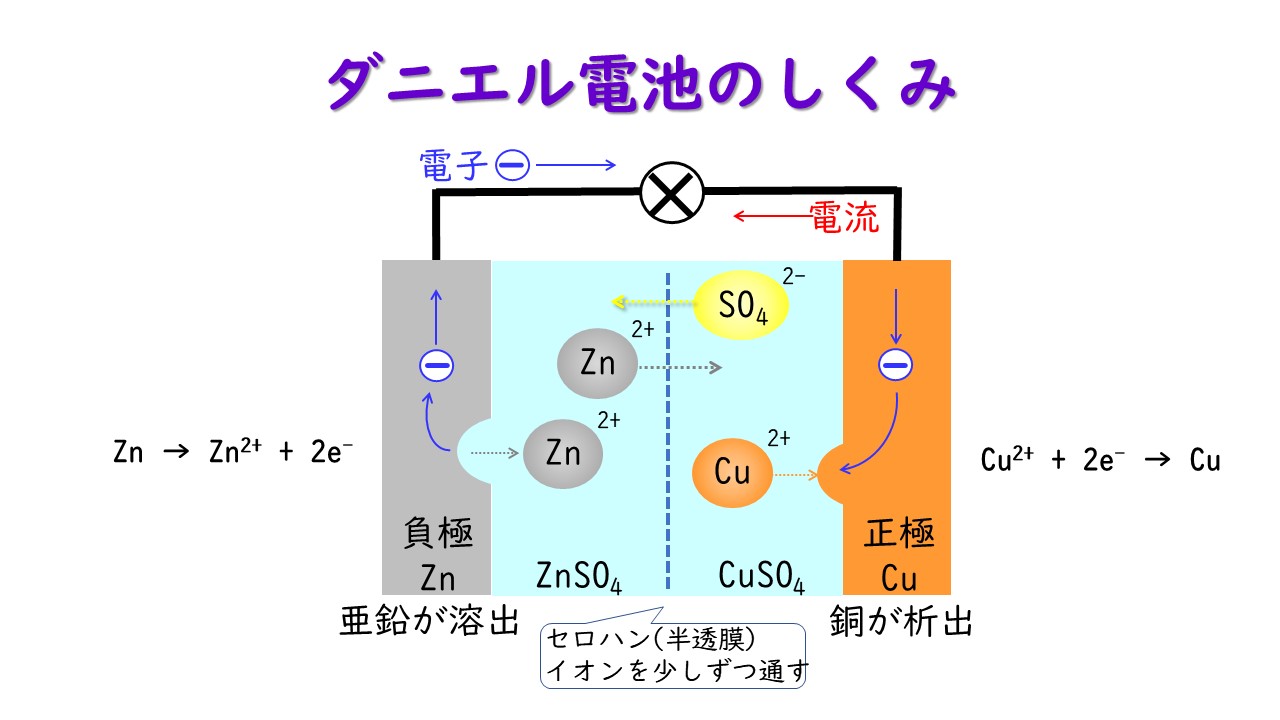



ダニエル電池で発電しよう お茶の水女子大学 理科教材データベース



理科 教科書改訂で理科はどれくらい難しくなるの ダニエル電池 個別指導塾のyou 学舎日記 公式ブログ



7 6 電池 1 おのれー Note
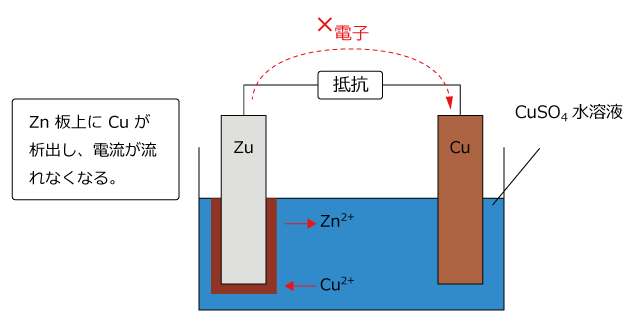



化学講座 第25回 電池 ボルタの電池とダニエル電池 私立 国公立大学医学部に入ろう ドットコム




理論 ボルタ電池 ダニエル電池 受験 定期テストで高校化学を完全攻略




ダニエル電池で発電しよう お茶の水女子大学 理科教材データベース




ボルタ電池とダニエル電池の電池式と分極
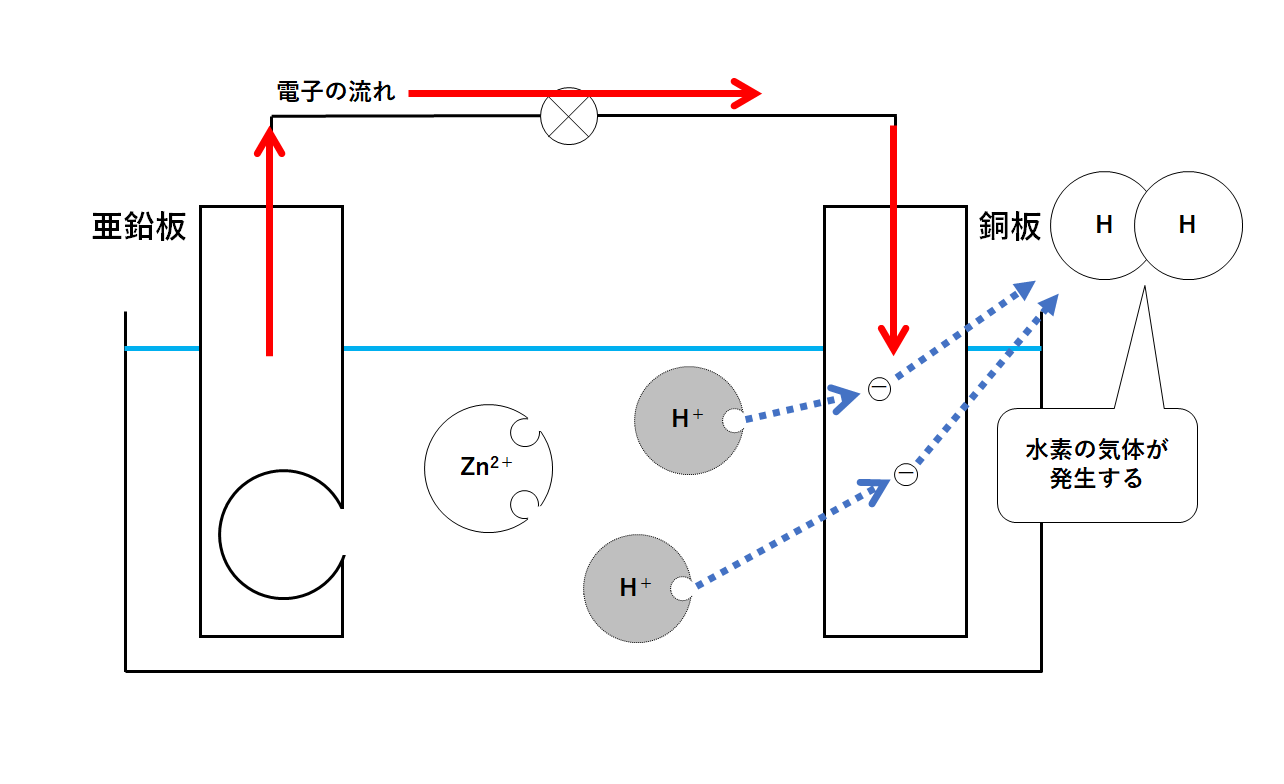



中3化学 電池の仕組み 中学理科 ポイントまとめと整理
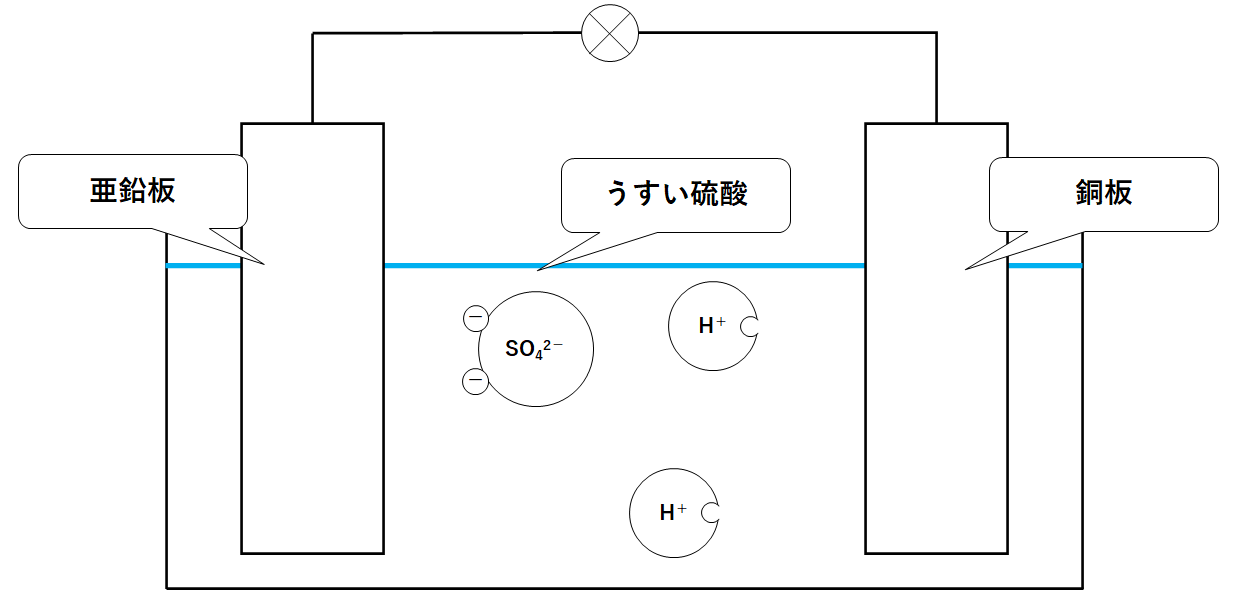



中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理



ダニエル電池で素焼き板をとると 溶液内で反応が完結するため 電流が取り出せない Yahoo 知恵袋




ダニエル電池 仕組み 各極の反応式 素焼き版 起電力など 化学のグルメ
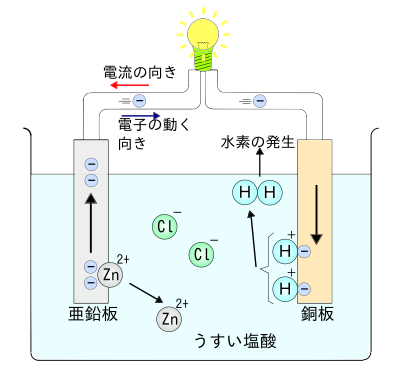



高等学校化学i 電池と電気分解 Wikibooks
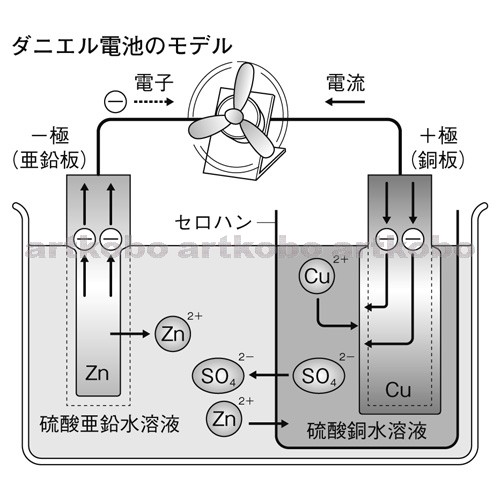



Web教材イラスト図版工房 R C1m ダニエル電池のモデル




ダニエル電池とは 仕組みを詳しく解説 高校生向け受験応援メディア 受験のミカタ




電気化学 Yakugaku Lab
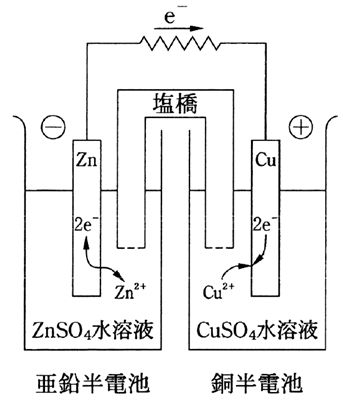



薬剤師国家試験過去問題 薬学 ダニエル電池 回問 解説
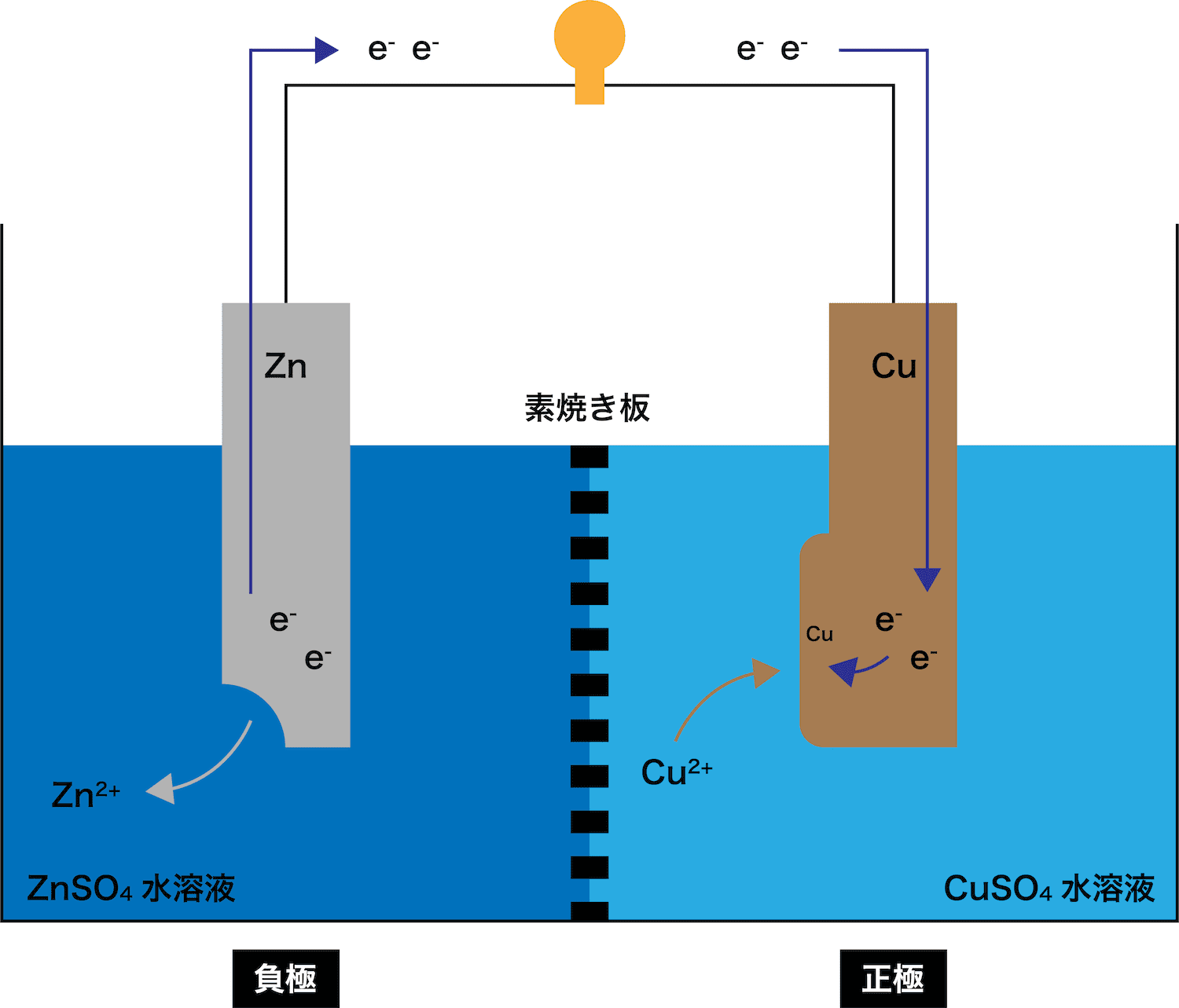



ダニエル電池 仕組み 各極の反応式 素焼き版 起電力など 化学のグルメ
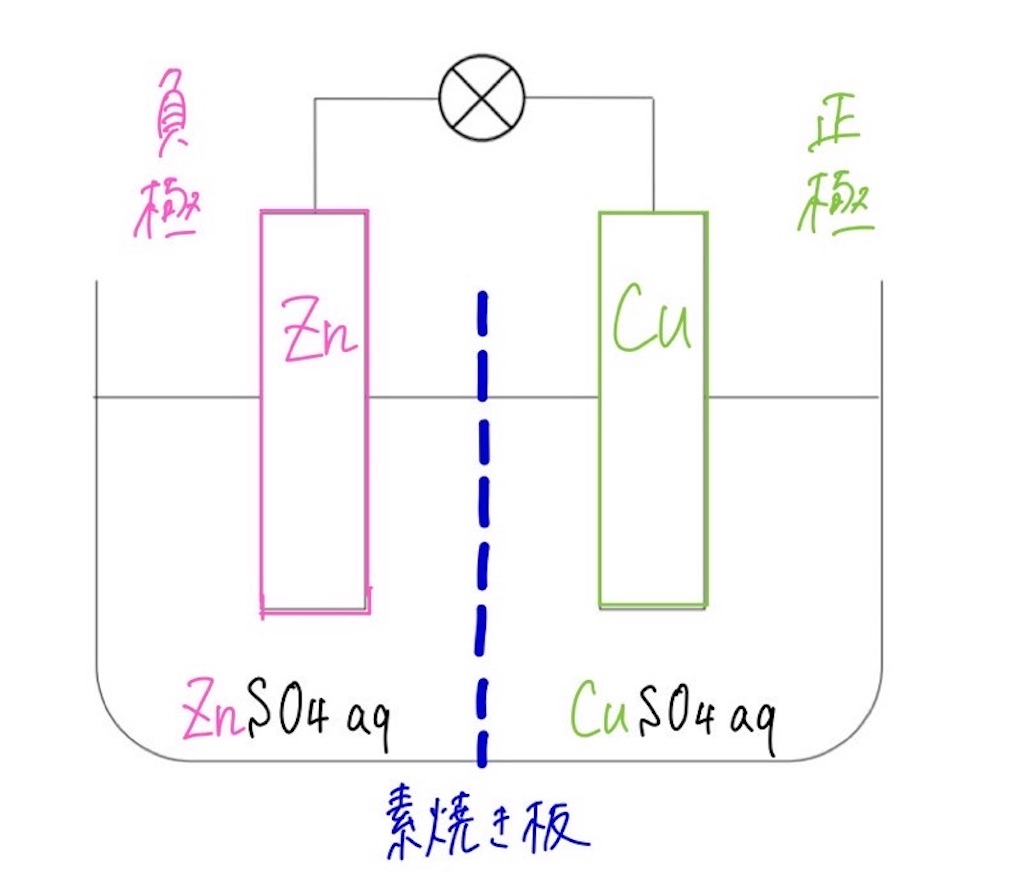



高校化学 ダニエル電池の原理を徹底解説 ボルタ電池との違いや素焼き板の意味は 化学の偏差値が10アップするブログ



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Daniell Cell




ダニエル電池とは 仕組みを詳しく解説 高校生向け受験応援メディア 受験のミカタ
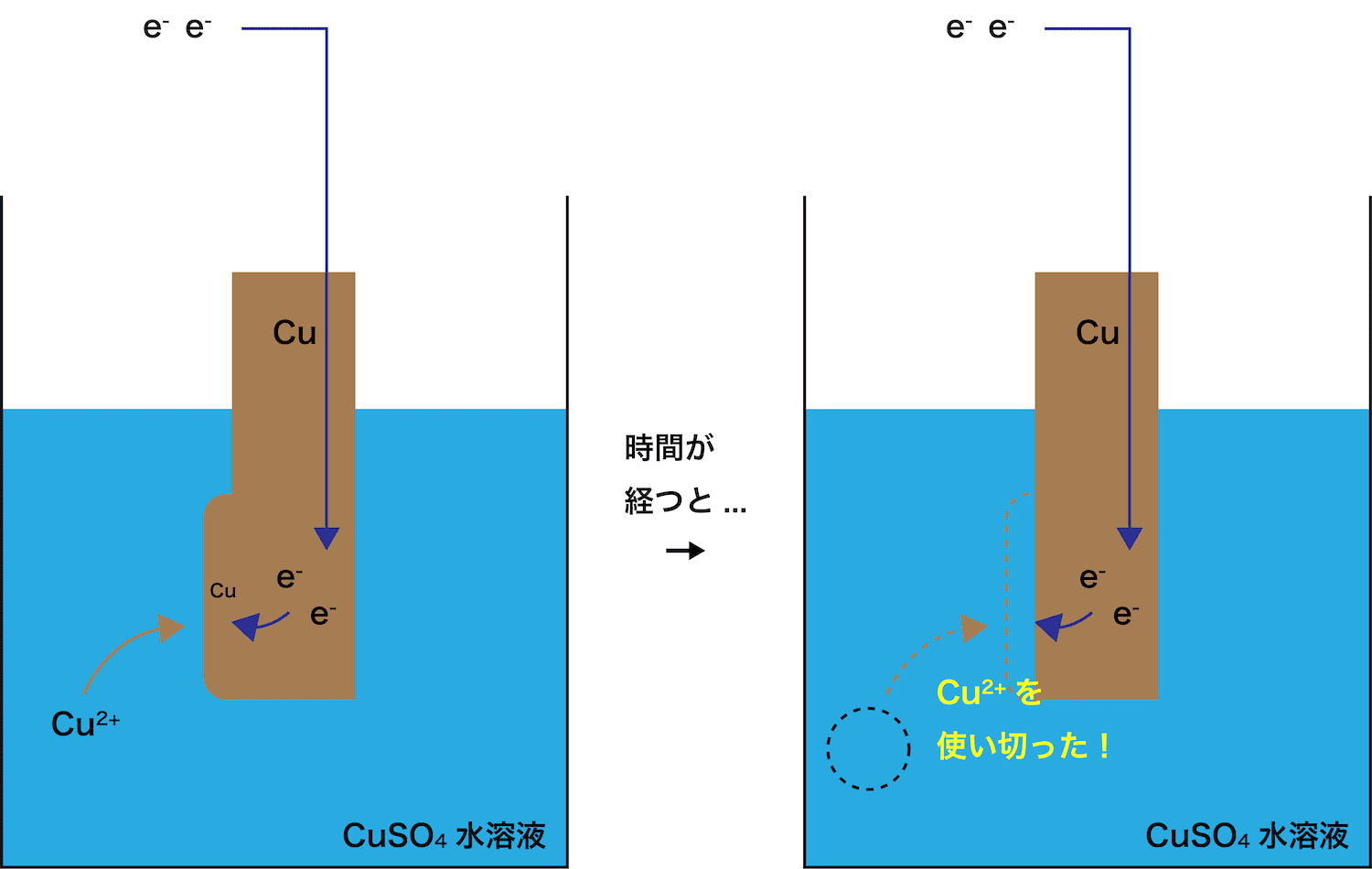



ダニエル電池 仕組み 各極の反応式 素焼き版 起電力など 化学のグルメ
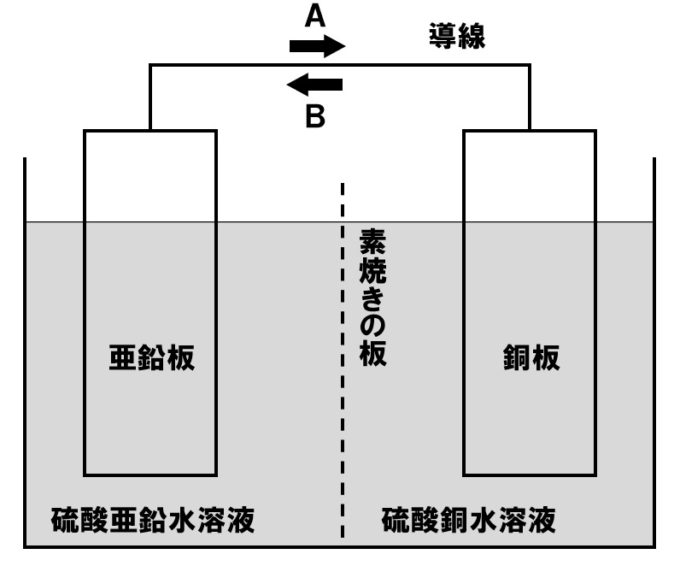



中3理科 ダニエル電池の定期テスト対策問題 Examee



中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理



改良されたボルタ電池 この世を科学的に知ろう



Q Tbn And9gctpv1r Co7qhljdw0nq75rj9o Uuhhcgyrzy8wcochuztkqbqux Usqp Cau



ダニエル電池の構成 仕組み 反応式は 正極 負極の反応は 素焼き板の役割は




ボルタ電池 仕組み 欠点 分極 起電力 西住工房



ボルタ電池 仕組み 欠点 分極 起電力 西住工房




ダニエル電池って その仕組みを理系学生ライターが5分で解説 Study Z ドラゴン桜と学ぶwebマガジン



Qck0d2a9as2853cudbqy0lc6cfz4a0e7e Xyz Theory Daniell Cell



この問題の解き方を教えてください 単純に2mol 22 4m Yahoo 知恵袋



化学魔の還元 電池電解編 3 ダニエル電池



Www Mext Go Jp Component A Menu Education Detail Icsfiles Afieldfile 0427 Mxt Kouhou02 181 Pdf



化学 電池 技術情報館 Sekigin 電極反応の理解を深めるため 化学物質の酸化還元反応を利用して電気を取り出す電池 Cell ボルタ電池 ダニエル電池 鉛蓄電池 リチウム電池 燃料電池の基本原理を紹介



Gakusyu Shizuoka C Ed Jp Science Sonota Ronnbunshu H29 Pdf




ダニエル電池とは 仕組みを詳しく解説 高校生向け受験応援メディア 受験のミカタ



Www Jst Go Jp Cpse Jissen Pdf Houkoku Sg A Pdf



中学校選択理科化学
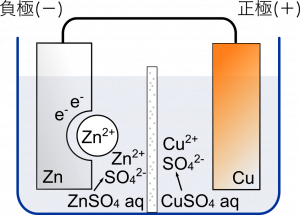



高校化学基礎 化学電池の仕組み Mm参考書



化学 ダニエル電池に関する質問です セロハンや 素焼き板の役 Yahoo 知恵袋




中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理



ボルタ電池とダニエル電池の違い 改良点を理解しよう




高校化学 化学反応とエネルギー14 ダニエル電池の仕組み 8分 Youtube




中3化学 ダニエル電池の仕組み 中学理科 ポイントまとめと整理




ダニエル電池とは 仕組みを詳しく解説 高校生向け受験応援メディア 受験のミカタ



ボルタ電池とダニエル電池の違い 改良点を理解しよう



化学 ダニエル電池の仕組み バイオハックch




ダニエル電池まとめ 起電力 素焼き板と濃度 原理 理系ラボ
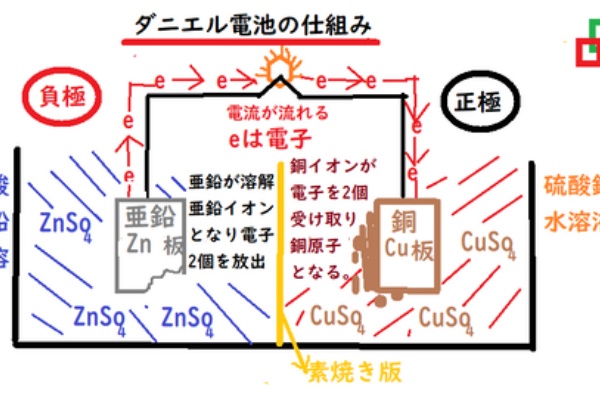



中学数学 理科 寺子屋塾の復習サイト 化学反応式 化合




高校理論化学 ボルタ電池とダニエル電池 受験の月
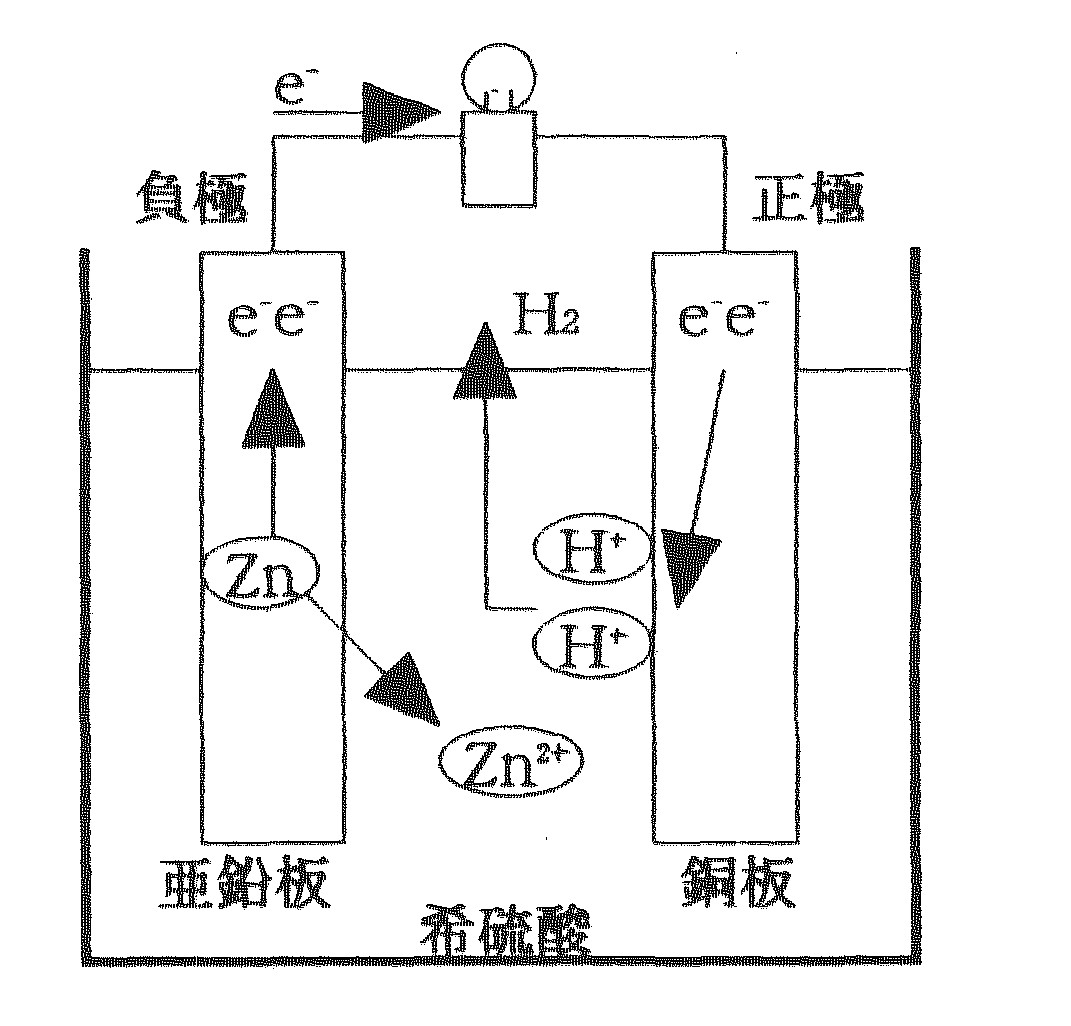



理論 ボルタ電池 ダニエル電池 受験 定期テストで高校化学を完全攻略
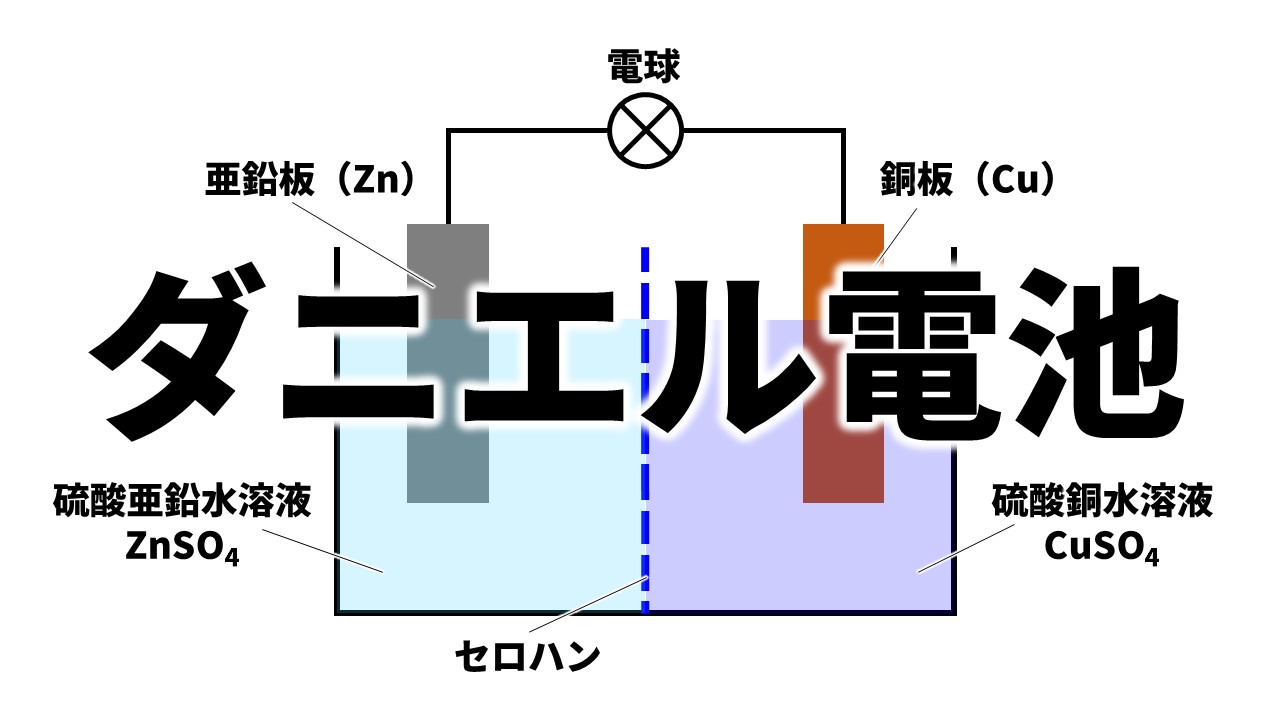



中3理科 ダニエル電池の定期テスト対策問題 Examee



0 件のコメント:
コメントを投稿